Е. Петрова 1 , кандидат медицинских наук, доцент,
А. Шутов 2 , доктор медицинских наук, профессор,
В. Струков 3 , доктор медицинских наук, профессор
1Пензенский государственный университет
2 Ульяновский государственный университет
3 Пензенский институт усовершенствования врачей –
филиал Российской медицинской академии непрерывного
профессионального образования Минздрава России
Врач №7, 2018
Распространенность эректильной дисфункции (ЭД) у пациентов с артериальной гипертензией достигает, по данным разных авторов, 70%, при этом течение как сексуальных, так и соматических нарушений отягощают сопутствующие тревожно-депрессивные расстройства. В результате увеличивается риск преждевременной смерти, ухудшается прогноз и снижается социальное функционирование таких пациентов. Общими патогенетическими механизмами указанной сочетанной патологии являются снижение уровня оксида азота, низкий уровень андрогенов, нарушение кортико-висцеральных связей с дисбалансом гипоталамо-гипофизарнонадпочечниковой системы и симпатикотонией. С учетом сложных патофизиологических связей больным необходимо назначение адекватной гипотензивной и психокоррекционной терапии, а также эффективное лечение ЭД.
Ключевые слова: эректильная дисфункция, тревожно-депрессивные расстройства, артериальная гипертензия, патогенетические связи, ингибиторы фосфодиэстеразы, адаптогены.
Рассматриваемая триада патологических состояний (Mutually reinforcing triad [1]) – сочетание эректильной дисфункции (ЭД), тревожно-депрессивного расстройства (ТДР) и артериальной гипертензии (АГ) является одной из главных проблем мужского здоровья в XXI веке. Это обусловлено широкой распространенностью, медико-социальной значимостью, а также общностью патогенетических механизмов перечисленных нарушений [2].
ЭД определяется как неспособность достигать и (или) поддерживать адекватную эрекцию, необходимую для полноценного полового акта [2]. В мире около 400 млн мужчин страдают ЭД; по прогнозам, к 2025 г. эта цифра увеличится до 900 млн, что связано как с негативным влиянием на половую функцию различных факторов риска ЭД (гипертензия, курение, ожирение, дислипидемия, сахарный диабет), так и с ожидаемым ростом продолжительности жизни мужского населения на планете и, как следствие, усилением влияния еще одного важного фактора риска ЭД – старения с возрастным андрогенным дефицитом [3, 4]. Проведенное в России в 2012 г. первое масштабное исследование распространенности ЭД [5] продемонстрировало неутешительные результаты: из 1225 респондентов симптомы ЭД были выявлены у 1101 (89,9%).
Сексуальное функционирование тесно связано с физическим и психосоциальным здоровьем мужчин и оказывает значительное влияние на качество жизни (КЖ) больных и их семей. По данным E. Laumann и соавт. [6], расстройство эрекции, часто сопровождающееся тревожностью, подавленностью и неуверенностью в себе, снижает физическую составляющую КЖ более чем в 4 раза, а психоэмоциональную – более чем в 2 раза. Другие исследователи сообщают о прямой корреляции половой активности с продолжительностью жизни мужчин. Результаты Кайерфилского проспективного 10-летнего когортного исследования показали [7], что смертность мужчин с низкой половой активностью (<1 полового контакта в месяц) на 50% выше, чем среди имевших половые контакты ≥2 раза в неделю.
В ходе недавнего исследования во Флориде (участвовали 22 654 мужчин и женщин старше 55 лет) было установлено, что сохраненная сексуальная активность ассоциируется с положительными физическими, социальными и эмоциональными показателями состояния здоровья [8].
ПАТОГЕНЕТИЧЕСКИЕ ВЗАИМОСВЯЗИ ЭД, ТДР И АГ
Если раньше основной причиной ЭД считали проблемы психогенного характера, то сегодня установлено, что в большей степени они органической и смешанной природы. В любом случае сопутствующие тревога и депрессия отягощают течение как сексуальных, так и соматических нарушений.
Клинические исследования указывают на тесную связь ЭД с сердечно-сосудистыми заболеваниями (ССЗ) [9]. По данным F. Giuliano и соавт. [10], ЭД выявляется почти у 70% мужчин с АГ, в том числе тяжелая ее степень – у 45,2% (в общей популяции – у 10%). С помощью допплерографии сосудов полового члена ЭД была определена у 87% пациентов с АГ [11]. Важнейшим патогенетическим звеном как гипертензии, так и ЭД являются дисфункция эндотелия и недостаточная продукция оксида азота (NO) – основного модератора системного и органного кровотока. Повышенное АД, особенно на фоне старения, сопровождается нарушением эндотелийзависимой вазодилатации с последующим структурным ремоделированием, развитием атеросклероза и стенозом кровеносных сосудов, обеспечивающих кровоток во время эрекции [12, 13]. Утяжелению эндотелиальной дисфункции и возникновению ЭД способствует хроническое сосудистое воспаление. Повышенные уровни маркеров и медиаторов воспаления (С-реактивный белок, молекула межклеточной адгезии 1-го типа, интерлейкины – ИЛ6, -10, -1β, фактор некроза опухоли-α) и эндотелиальных/протромботических факторов (фактор фон Виллебранда, тканевый активатор плазминогена, ингибитор активатора плазминогена-1, фибриноген) отмечены у больных с ЭД [14, 15].
Доказано, что ЭД является ранним маркером или предшественником ССЗ. P. Montorsi и соавт. [16] показали, что в большинстве случаев ЭД предшествует развитию острого коронарного синдрома и стенокардии напряжения, причем интервал между этими событиями в среднем составляет 12–36 мес. Это объясняется тем, что диаметр пенильных артерий в 2–3 раза меньше, чем коронарных сосудов, и в 3–4 раза – чем сонных артерий, а потому клинические проявления ЭД или атеросклеротическое поражение сосудов полового члена становятся очевидными гораздо раньше, чем такие же патологические нарушения в более крупных коронарных или периферических сосудах.
Еще одним важным звеном сочетанной патологии является низкий уровень андрогенов (гипогонадизм). Установлено, что тестостерон и его активные метаболиты не только контролируют адекватное сексуальное функционирование, но и определяют риск развития неблагоприятных сердечно-сосудистых событий (ССС) и сердечно-сосудистой смертности. АГ, являющаяся одним из основных факторов риска ССЗ, также связана с низким уровнем тестостерона. В исследовании C. Vlachopoulos и соавт. [17], у 228 пациентов с АГ без клинических симптомов атеросклероза оценивали связь низкого уровня тестостерона и развития серьезного ССС. Было выявлено, что в течение 44 мес наблюдения у 19 (8,3%) участников произошли следующие ССС: сердечно-сосудистая смерть, инфаркт миокарда или инсульт. По сравнению с пациентами, у которых ССС не произошли, при ССС у мужчин с АГ была более низкая концентрация общего тестостерона – Тобщ (соответственно 13,5±2,4 и 15,9±5,2 нмоль/л; р<0,01) и более часто встречался гипогонадизм (у 36 и 16%; р<0,05).
Тестостерон оказывает вазо- и кардиопротективное действие через NO, влияет на эндотелий и маркеры воспаления, а его дефицит проявляется нарушениями со стороны сердечно-сосудистой системы в виде плохо корректируемой АГ, ухудшения метаболизма липидов и углеводов, прогрессированием атеросклеротического ремоделирования сосудов [18, 19]. К тому же недостаток андрогенов способствует снижению психофизической активности и либидо, углублению
ЭД и психоэмоциональных расстройств – тревоги и депрессии, что соответствует лабораторным показателям Тобщ на уровне ≤15 нмоль/л [20]. Международное общество сексуальной медицины рекомендует определять уровень Тобщ у пациентов с ЭД и (или) пониженным либидо [21].
Наличие тревоги и депрессии у пациентов с ЭД и АГ осложняет течение коморбидной патологии, служит фактором риска преждевременной смерти, ухудшения прогноза и снижения социального функционирования [22]. Так, у больных с АГ наличие только ТДР связано с возрастанием риска инсульта на 18% и сердечнососудистой смертности на 25% [23]. Сейчас рассматривается несколько возможных общих механизмов влияния ТДР на прогрессирование как АГ, сердечнососудистой патологии, так и ЭД. Наиболее важными являются гиперактивность гипоталамо-гипофизарно-надпочечниковой системы и дисбаланс автономной нервной системы с преобладанием симпатикотонии [24, 25]; нарушение функционального состояния тромбоцитов, повышение вязкости крови и дисфункция эндотелия [24]; повышение уровня хронического воспалительного ответа [24–26].
Депрессивные расстройства существенно снижают приверженность антигипертензивной терапии [27]. Такие пациенты не соблюдают режим лечения, реже придерживаются здорового образа жизни (это касается как соблюдения диеты, так и отказа от курения, увеличения физической активности, ограничения приема алкоголя) [28]. В Европейских рекомендациях по профилактике ССЗ в клинической практике (2016) депрессия и тревога рассматриваются как значимые препятствия в модификации образа жизни пациентов в желаемом направлении, требующие психокоррекционной работы [29].
Кроме того, отрицательную роль в развитии ЭД играют антигипертензивные препараты – неселективные β-адреноблокаторы, тиазидные диуретики [30–32] и психотропные средства – антидепрессанты и транквилизаторы [33]. Признаками медикаментозно-индуцированной ЭД являются относительно быстрое развитие, наличие временнóй связи возникновения с приемом лекарственного средства, а также уменьшение выраженности расстройства или полное его исчезновение после отмены препарата. Именно поэтому пациенты с триадой ЭД, ТРД и АГ нуждаются в адекватной гипотензивной терапии с применением ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина [30–32], а также в психотропном лечении атипичными антидепрессантами (например, бупропионом – селективным ингибитором обратного захвата норадреналина и дофамина, тразодоном – антагонистом серотониновых рецепторов 5-HT2A/2C, агомелатином – агонистом мелатонинергических рецепторов MT1 и MT2) [33]. Перечисленные препараты не только не вызывают ухудшения эректильной функции, но и оказывают положительное действие на нее
ОСОБЕННОСТИ ТЕРАПИИ ЭД И ТДР У ПАЦИЕНТОВ С АГ
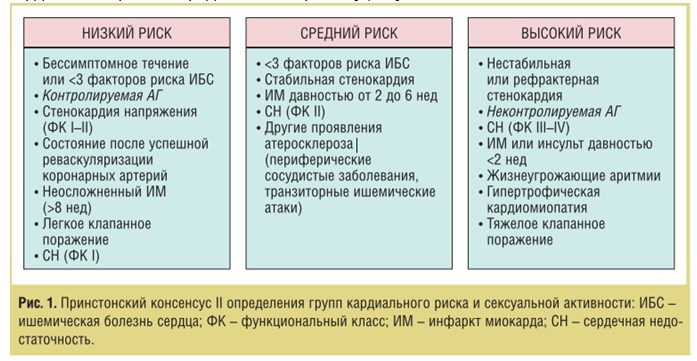
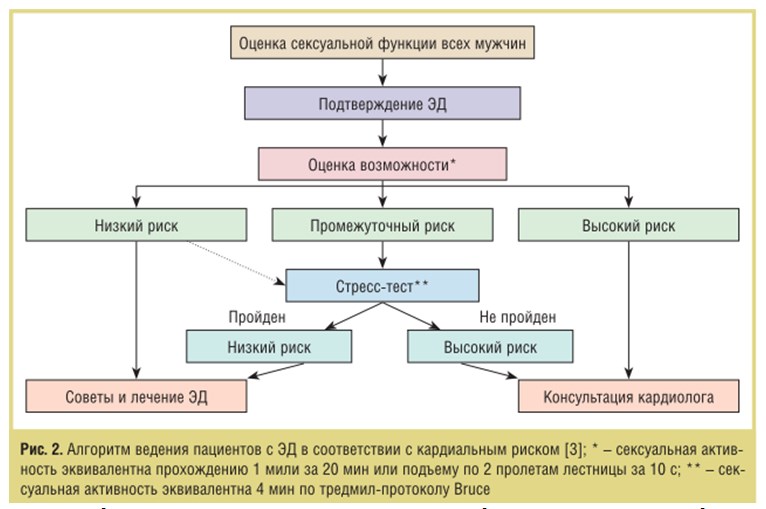
Сложные патогенетические связи ЭД и ТДР при АГ требуют особого подхода к лечению. Важным вопросом как для больных, так и для врачей-интернистов является безопасность сексуальной активности при АГ. Согласно Пристонскому консенсусу II (рис. 1) [3], пациенты с контролируемой АГ относятся к группе с низким уровнем риска и могут безопасно продолжать половые отношения и использовать препараты для лечения ЭД. Пациенты с неконтролируемой АГ, имеющие 10-кратный риск развития ССС во время полового акта, а также в течение последующих 2 ч, относятся к группе с высоким уровнем риска и нуждаются в консультации кардиолога и отказе от сексуальной активности до стабилизации состояния. Алгоритм ведения больных в соответствии с кардиальным риском представлен на рис. 2 [3, 34].
После подбора антиги-пертензивных препаратов могут быть рекомендованы ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5), являющиеся «золотым стандартом» фармакотерапии 1-й линии ЭД, – силденафил, тадалафил, варденафил [35].
Однако до сих пор не решен ряд проблем, в том числе это нежелательные побочные эффекты, присущие ингибиторам ФДЭ-5 (головная боль, гиперемиялица, диспепсия, заложенность носа, миалгии), а также нечувствительность к терапии у 15–40% пациентов. Как известно, эти средства способны потенцировать релаксирующее действие NO на гладкомышечные клетки трабекулярной ткани. Однако пусковым моментом для высвобождения NO из нервных окончаний являются импульсы, поступающие из центральной нервной системы. Их интенсивность зависит отреакции пациента на сексуальный раздражитель. Прирезком снижении либидо (а именно оно угасает с возрастом в первую очередь) монотерапия ингибиторами ФДЭ-5 малоэффективна из-за отсутствия субстрата дляих действия. Поэтому сегодня весьма актуален вопрособ оптимизации клинического применения ингибиторов ФДЭ-5 при лечении пациентов с ЭД [36]. Что касается андрогензаместительной терапии, то, несмотря наразнообразие лекарственных форм, вопросы остаются и здесь (в частности, это подавление продукции эндогенных андростероидов, отрицательные воздействия напечень, предстательную железу).
Использование препаратов природного происхождения с минимальным количеством побочных эффектов и при этом обладающих способностью повышать сексуальное влечение и улучшать качество эрекции, повышать настроение и стабилизировать вегетативную систему является хорошей альтернативой и дополнением в лечении ЭД у мужчин с АГ. В изучении клиникодинамической оценки ЭД и ТДР с нашим участием у 78 мужчин с гипертонической болезнью I–III cтадии на фоне комплексной терапии [37–39] наряду с анти-гипертензивными препаратами был использован адаптоген отечественного производства (Эромакс, компания «Парафарм»), содержащий трутневый расплод, пчелиную обножку, корень женьшеня, L-аргинин, цитрат цинка, пиридоксина гидрохлорид. Пациенты были разделены на 2 группы, сопоставимые по возрасту и тяжести расстройств. Больные 1-й группы (n=55) получали антигипертензивную терапию и адаптоген; 2-й (n=23) – только антиги- пертензивные средства. Дополнительно с целью редукции выраженной аффективной патологии в обеих группах использовались малые дозы антидепрессанта (тразодон в дозе 50–150 мг/сут), а также индивидуальная и (или) супружеская когнитивно-поведенческая психотерапия. К моменту завершения лечения изучение гормонального статуса в 1-й группе продемонстрировало достоверное повышение содержания Тобщ и тенденцию к увеличению содержания дегидроэпиандростерона сульфата (ДГЭА-С) на фоне снижения уровня пролактина, в отличие от 2-й группы, где достоверных изменений гормонального фона не отмечено (табл. 1). В 1-й группе достоверно повысились все интегративные показатели опросника «Международный индекс эректильной функции» (МИЭФ) (табл. 2). По Госпитальной шкале тревоги и депрессии (ГШТД) у больных 1-й группы установлено более значимое редуцирование уровня тревоги и депрессии. Если до лечения средний уровень тревоги расценивался как клинический и был сопоставим в обеих группах (11,5±0,6 и 11,3±0,7 балла), то после лечения в 1-й группе он уменьшился до нормы (6,9±0,3 баллов; p<0,02), а во 2-й остался субклиническим. Средний уровень депрессии по шкале HADS в начале терапии приближался к клиническому (10,8±0,5 балла в 1-й группе и 11,0±0,2 – во 2-й), а к контрольному, 28-му дню исследования показатели депрессии редуцировались до нормы (6,7±0,3 балла; p<0,02) – только в 1-й группе.
Таблица 1 Динамика уровня тестостерона, пролактина и ДГЭА-С в сыворотке крови на фоне проводимой терапии (M±m)
| Показатель | 0-й день | 28-й день | Норма | р | ||
| 1-я группа | 2-я группа | 1-я группа | 2-я группа | |||
| Т
общ , нмоль/л |
11,8±4,4 | 11,4±3,8 | 17,1±5,7* | 13,4±3,1 | 12,1–38,3 | <0,02 |
| Пролактин, мЕ/л | 521±36 | 517±29 | 285±60* | 460±69 | 24,5–467 | <0,02 |
| ДГЭА-С, мкг/мл | 1,2±0,3 | 1,3±0,1 | 1,4±0,7 | 1,3±0,2 | 1,0–4,2 | >0,054 |
Примечание. * – различия достоверны по сравнению с исходными показателями (здесь и в табл. 2).
Таблица 2 Динамика показателей МИЭФ (M±m)
| Показатель | 0-й день | 28-й день | ||
| 1-я группа | 2-я группа | 1-я группа | 2-я группа | |
| ЭД | 13,4±0,7 | 12,9±0,8 | 19,8±0,6* | 14,8±0,7 |
| Удовлетворенность половым актом | 9,6±0,4 | 9,8±0,5 | 14,1±0,7* | 12,8±0,4 |
| Оргазм | 5,1±0,4 | 5,7±0,2 | 8,8±0,2* | 5,9±0,8 |
| Либидо | 6,1±0,5 | 6,3±0,1 | 10,9±0,3* | 8,1±0,1 |
| Общая удовлетворенность | 5,8±0,1 | 5,9±0,7 | 10,1±0,9* | 7,0±0,7 |
ЗАКЛЮЧЕНИЕ
ЭД и ТДР часто наблюдаются у мужчин с АГ. Сочетанная патология значительно увеличивает риск преждевременной смерти, ухудшает прогноз и снижает КЖ пациентов. Общими патогенетическими звеньями ЭД, ТДР и АГ являются эндотелиальная дисфункция, низкий уровень андрогенов, дисбаланс гипоталамо-гипофизарно-надпочечниковой системы с симпатикотонией. Собственно ЭД служит ранним маркером или предшественником ССЗ и представляется ценным диагностическим симптомом для врачей-интернистов. При наличии триады изменений (ЭД, ТРД и АГ) требуются назначение адекватной антигипертензивной и психокоррекционной терапии, а также комплексное восстановление сексуальной функции, а следовательно, это проблема междисциплинарного взаимодействия врачей разных специальностей – кардиолога, психиатра, сексолога, уролога и эндокринолога.
Литература
- Goldstein The mutually reinforcing triad of depressive symptoms, cardiovascular disease, and erectile dysfunction // Am. J. Cardiol. 2000; 86 (2): 41–5.
- El-Sakka Erectile dysfunction, depression, and ischemic heart disease: does the existence of one component of this triad necessitate inquiring the other two? // J. Sex Med. – 2011; 8 (4): 937–40.
- Hatzimouratidis K., Eardley I., Giuliano F. et al. Guidelines on male sexual dysfunction: erectile dysfunction and premature ejaculation. European Association of Urology Web http://uroweb.org/guideline/male-sexual-dysfunction/ Updated 2015.
- Lewis R., Fugl-Meyer K., Corona G. et al. Definitions / epidemiology / risk factors for sexual dysfunction // J. Sex Med. – 2010; 7: 1598–607.
- Пушкарь Д.Ю., Камалов А.А., Аль-Шукри С.Х. и др. Первое пилотное эпидемиологическое исследование распространенности эректильной дисфункции в Российской Федерации. Эффективная фармакотерапия // Эндокринология. – 2013; 1 (9): 28–31.
- Laumann E. et Sexual dysfunction in the United States: Prevalence and predictors // JAMA. – 1999; 281: 537–44.
- Smith D., Frankel S., Yamell J. Sex and death: are they related? Findings from the Caerphilly Cohort Study // – 1997; 315: 1641–4.
- Bach L., Mortimer J., Van de Weerd C. et al. The association of physical and mental health with sexual activity in older adults in a retirement community // J. Sex Med. – 2013; 10 (11): 2671–8.
- Gandaglia , Briganti A., Jackson G. et al. A systematic review of the association between erectile dysfunction and cardiovascular disease // Eur. Urol. – 2014; 65: 968–78.
- Giuliano F., Leriche A., Jaudinot E. et al. Prevallence of erectile dysfunction among 7689 patients with diabbetes or hypertension, or both // J. Urol. – 2004; 64: 1196–201.
- Vlachopoulos C. Definition and Assessment of Erectile Dysfunction. In: M. Viigimaa, C. Vlachopoulos, M.Doumas. Erectile Dysfunction in Hypertension and Cardiovascular Disease / Springer International Publishing, Switzerland, 2015; pp. 9–17.
- Clavijo , Miner M., Rajfer J. Erectile Dysfunction and Essential Hypertension: The Same Aging-related Disorder? // Rev. Urol. – 2014; 16: 167–71.
- Blick , Ritchie R., Sullivan M. Is Erectile Dysfunction an Example of Abnormal Endothelial Function? // Curr. Vasc. Pharmacol. – 2016; 14 (2): 163–7.
- La Vignera S., Condorelli R., Vicari E. et al. Arterial erectile dysfunction: reliability of new markers of endothelial dysfunction // J. Endocrinol. Invest. – 2011; 34 (10): 314–20.
- Arana Rosainz Mde , Ojeda M., Acosta J. et al. Imbalanced lowgrade inflammation and endothelial activation in patients with type 2 diabetes mellitus and erectile dysfunction // J. Sex Med. – 2011; 8: 2017–30.
- Мontorsi P., Montorsi F., Schulman C. Is erectile dysfuncttion the «tip of the iceberg» of a systemic vascular disorder? // Eur. Urol. – 2003; 44: 352–4.
- Vlachopoulos , Ioakeimidis N, Terentes-Printzios D. et al. Plasma total testosterone and incident cardiovascular events in hypertensive patients // Am. J. Hypertens. – 2013; 26: 373–81.
- Novo S., Iacona R., Bonomo V. et al. Erectile dysfunction is associated with low total serum testosterone levels and impaired flow-mediated vasodilation in intermediate risk men according to the Framingham risk score // Atherosclerosis. – 2015; 238 (2): 415–9.
- Spitzer M., Basaria S, Travison T. et al. The effect of testosterone on mood and well-being in men with erectile dysfunction in a randomized, placebo-controlled trial // Andrology. – 2013; 1 (3): 475–82.
- Lunenfeld B., Mskhalaya G., Zitzmann M. et al. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men // Aging – 2015; 18 (1): 5–15.
- Dean J., McMahon C., Guay A. et al. The International Society for Sexual Medicine’s Process of Care for the Assessment and Management of Testosterone Deficiency in Adult Men // J. Sex Med. – 2015; 12 (8): 1660–86.
- Gathright E., Goldstein C., Josephson R. et al. Depression increases the risk of mortality in patients with heart failure: A meta-analysis // J. Psychosom. Res. – 2017; 94: 82–9.
- Scalco , Scalco M., Azul J. et al. Hypertension and depression // linics. – 2005; 60 (3): 241–50.
- Нуралиева Н.Ф., Напалков Д.А. Депрессия и кардиоваскулярные болезни // Вестн. РАМН. – 2014; 9–10: 21–6.
- Fiedorowicz J. Depression and cardiovascular disease: an update on how course of illness may influence risk // Curr. Psychiatry Rep. – 2014; 16 (10): 492.
- Finnell J., Wood S. Neuroinflammation at the interface of depression and cardiovascular disease: Evidence from rodent models of social stress // Neurobiol. Stress. – 2016; 4: 1–14.
- Atlantis E., Shi Z., Penninx B. et al. Chronic medical conditions mediate the association between depression and cardiovascular disease mortality // Psychiatry Psychiatr. Epidemiol. – 2012; 47 (4): 615–25.
- Berntson , Stewart K., Vrany E. et al. Depressive symptoms and self- reported adherence to medical recommendations to prevent cardiovascular disease: NHANES 2005–2010 // Soc. Sci. Med. – 2015; 138: 74–81.
- Piepoli , Hoes A., Agewall S. et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR) // Eur. Heart J. – 2016; 37 (29): 2315–81.
- Мамедов М.Н. Проблемы мужского здоровья в кардиологической практике. 2 изд. / М.: Кардиопрогресс, 2014.
- Chrysant S. Antihypertensive therapy causes erectile dysfunction // Curr. Cardiol. – 2015; 30 (4): 383–90.
- Al Khaja K., Sequeira R., Alkhaja A. et al. Antihypertensive Drugs and Male Sexual Dysfunction: A Review of Adult Hypertension Guideline Recommendations // J. Cardiovasc. Pharmacol. Ther. – 2016; 21 (3): 233–44.
- DeLay K., Haney N., Hellstrom W. Modifying Risk Factors in the Management of Erectile Dysfunction: A Review // World Mens Health. – 2016; 34 (2): 89–100.
- Nehra , Jackson G., Miner M. et al. The Princeton III consensus recommendations for the management of erectile dysfunction and cardiovascular disease // Mayo Clin. Proc. – 2012; 87: 766–78.
- Yuan J., Zhang R., Yang Z. et al. Comparative effectiveness and safety of oral phosphodiesterase type 5 inhibitors for erectile dysfunction: a systematic review and network meta-analysis // Eur. – 2013; 63: 902.
- Калинченко С.Ю., Тюзиков И.А., Ворслов Л.О. и др. Эректильная дисфункция: парадоксы и парадигмы современной патогенетической фармакотерапии // Сonsilium Мedicum. – 2014; 16 (1): 78–82.
- Петрова Е.В., Вакина Т.Н. Терапевтическая коррекция уровня дегидроэпиандростерона-сульфата и тестостерона при сексуальных дисфункциях // Врач. – 2014; 1: 60–1.
- Петрова Е.В., Вакина Т.Н., Бурмистрова Л.А. Сексуальные дисфункции при тревожно-депрессивных расстройствах // Лечащий врач. – 2014; 5: 108–11.
- Petrova , Shutov A. Therapeutic correction testosterone deficiency in hypertensive men with erectile dysfunction and depression // J. Sex Med. – 2016; 13 (5, Suppl. 2): 146.
PATHOGENETIC COMMUNICATION OF ERECTILE DYSFUNCTION, ANXIETY
AND DEPRESSIVE DISORDERS IN HYPERTENSION
Associate Professor E. Petrova 1 , Candidate of Medical Sciences; Professor
- Shutov 2 , MD; Professor V. Strukov 3 , MD
1 Penza State University
2 Ulyanovsk State University
3 Penza Institute for Postgraduate Training of Physicians, Branch, Russian Medical
Academy of Continuing Professional Education
Erectile dysfunction (ED) in patients with arterial hypertension (AH) is very common, reaching according to various authors 70%, with accompanying psychoemotional disorders aggravate the course of sexual as well as somatic disorders. Associated pathology increases the risk of premature death, worsens the prognosis and reduced social functioning of patients. The common pathogenetic mechanisms of ED, anxiety and depressive disorders and hypertension are endothelial dysfunction with decreased nitric oxide, low levels of androgens, the violation of cortico-visceral connections with the imbalance of the hypothalamic-pituitary-adrenal system and sympathicotonia. Complex pathophysiology requires prescription of adequate anti-hypertensive and psychotherapy, effective treatment of erectile dysfunction.
Key words: erectile dysfunction, anxiety and depressive disorders, arterial hypertension, pathogenetic relationship, Phosphodiesterase type 5 inhibitors, adaptogens.