Накоплено много научной информации о том, что женьшень для мужчин очень полезен. Однако до конца сложные механизмы его воздействия на человеческий организм ещё не изучены. Сложность в формировании полноценной базы научных данных о женьшене заключается в многочисленности его видов и неравнозначности терапевтических эффектов даже у экземпляров одного его вида, но различного возраста.
Почему женьшень женьшеню рознь
Дело в том, что по мере роста, в зависимости от места произрастания и вида, в женьшене существенно меняется количество и соотношение его основных действующих веществ – гинзенозидов. Именно им приписываются основные эффекты растения, в том числе – благотворное влияние на половую сферу мужчин.
Однако учёные выяснили, что отнюдь не все гензинозиды улучшают потенцию. Более того, некоторые из них, особенно при повышенной дозировке, способны наоборот подавлять мужскую силу. Поэтому наш препарат для устранения половых дисфункций «Эромакс» содержит женьшень в умеренной дозировке – 45 мг, что при приёме рекомендуемых 6 таблеток составит 270 мг в сутки.
Женьшень и мужская репродуктивная функция: обзор научных исследований
Ниже мы предлагаем вашему вниманию опубликованную на сайте Национального института здоровья США статью Kar Wah Leung и Alice ST Wong «Женьшень и мужская репродуктивная функция». Данный научный обзор обобщает современные знания о влиянии женьшеня на мужскую репродуктивную систему.К сожалению, во многих анализируемых работах возраст и химический состав исследуемых растений не учитывался.
Учёные подчёркивают выявленную в подавляющем большинстве положительную корреляцию (взаимосвязь) между женьшенем, либидо и половыми отношениями. В работе рассмотрены механизмы действия женьшеня, открывающие новые перспективы в терапии нарушений мужской половой системы.
Женьшень для мужчин: чем полезен?
Положительное влияние женьшеня, в частности корейского красного женьшеня, на эректильную функцию и сексуальное удовлетворение связано с активизацией синтеза оксида азота (NO) и усилением чувствительности к нему клеток гладкой мускулатуры стенок сосудов, что способствует увеличению сперматогенеза.
Женьшень для мужчин – отличное средство повышения либидо. Однако при изучении его действия на мышах было установлено, что либидо росло лишь при получении грызунами азиатского женьшеня (гинзенозидов Rg1), а от американского женьшеня (гинзенозидов Rb1, Rb2 и Ro) такого эффекта не наблюдалось. Из чего исследователи сделали вывод, что американский женьшень, в отличие от Азиатского, и длительность лечения могут иметь иное действие на либидо.
В других рассматриваемых в обзоре исследованиях была выявлена способность отдельных гинзенозидов(Rc,Rb2,Re) повышать численность и подвижность сперматозоидов.
Kar Wah Leung и Alice ST Wong рассматривают протективные свойства женьшеня, способного улучшать половую функцию мужчин при различных заболеваниях и повреждающих внешних воздействиях. Накоплен убедительный багаж данных об улучшении сперматогенеза у онкологических больных, получающих лучевую терапию, лечение цитостатиками(«Циклофосфамидом», «Бусульфаном»). Растение показало себя эффективным в борьбе с бесплодием, вызванным противораковой терапией. Помогает женьшень и при сексуальных дисфункциях, связанных с сахарным диабетом II типа, и при метаболическом синдроме. Снижает воздействие токсинов окружающей среды.
Гормональные механизмы воздействия женьшеня на мужчин
По химической структуре гинзенозиды схожи со стероидными гормонами. По мнению ряда учёных, в этом и кроется секрет их воздействия на половую сферу. Путём стимуляции стероидных рецепторов они активизируют сперматогенез. В частности, отклик у андрогенных рецепторов способны вызывать гинзенозиды Rb1 и Re. В результате их взаимодействия увеличиваются выработка азота, сперматогенез и способность к эрекции.
Некоторые гинзенозиды (Rb1, Re, Rg1, Rg3, т Rh1)связываются с эстрогенными рецепторами. Хотя эстроген и считается женским гормоном, его уровень влияет также и на половую функцию мужчин, а рецепторы к нему обнаружены в плазматических мембранах человеческих сперматозоидов. Это наталкивает на вывод, что гинзенозиды могут корректировать мужскую сексуальную функцию посредством взаимодействия с рецепторами эстрогена.
Гинзенозиды также активизируют рецепторы прогестерона. В частности, способность гинзенозида Re улучшать подвижность сперматозоидов учёные связывают с его воздействием на рецепторы прогестерона и эстрогена.
Как видим, механизмы влияния женьшеня на репродуктивную систему связаны с гормональной системой и весьма сложны. В большинстве случаев они недостаточно прогнозируемы из-за неопределённости химического состава конкретного лекарственного сырья. Поэтому обращение с женьшенем требует осторожности. Высоких доз препаратов женьшеня лучше избегать.
«Женьшень и мужская репродуктивная функция»
Кар Ва Леунг (Kar Wah Leung) и Элис СТ Вонг (Alice ST Wong)
Резюме
Женьшень часто называют королем всех трав и считают многообещающим средством для улучшения общего самочувствия. Женьшень также славится как афродизиак и используется для лечения половой дисфункции и улучшения сексуального поведения в традиционной китайской медицинской практике. Данные об исследованиях на животных показали позитивную корреляцию между женьшенем, либидо и копулятивными характеристиками, и эти эффекты были подтверждены исследованиями «случай – контроль» на людях. Кроме того, обнаружено, что женьшень улучшает качество спермы и число сперматозоидов у здоровых мужчин, а также у пациентов с бесплодием, связанным с лечением. Эти эффекты в основном приписываются гинзенозидам, основным фармакологически активным компонентам женьшеня. Этот обзор представляет собой обобщение современных знаний о многосторонних действиях женьшеня на мужскую репродуктивную систему, а также обращает внимание на механизмы действия, которые могут представлять новые терапевтические стратегии в лечении заболеваний или нарушений мужской репродуктивной системы.
Ключевые слова: женьшень. Гинзенозиды, сексуальное поведение, сперма, сперматогенез, стероидный рецептор.
Введение
Бесплодие представляет собой все возрастающую мировую проблему. В 2010 году примерно 48,5 миллионов пар во всем мире страдали от бесплодия. Примерно в 40% этих пар партнер-мужчина был либо единственной, либо сопутствующей причиной бесплодия (2,3). Как способ лечения бесплодия во всем мире все более популярной становится фитотерапия. В Соединенных Штатах 17% постоянно посещали фитотерапевта в последние 18 мес. из 29% бесплодных пар, использовавших комплементарную и альтернативную медицину (3). В клиническом исследовании, проведенном в Иордании, 44% бесплодных пациентов используют растительные препараты как часть общего лечения бесплодия (4). Из них 8% прибегают к китайской медицине (4). В Южной Австралии 29% опрошенных пациентов с бесплодием применяли растительные средства, из которых 4,2% использовали женьшень (5).
Женьшень является одним из самых ценных растений в традиционной китайской медицине. Есть как минимум 9 видов женьшеня, большинство из них названо по имени географических регионов их происхождения, как например, Азиатский женьшень (Asian ginseng (Panax ginseng)), Американский женьшень (American ginseng (Panax quinquefolium)) и Японский женьшень (Japane seginseng (Panax japonicus)). Имя семейства “Panax” было дано женьшеню русским ботаником Карлом А. Мейером в 1843 г. “Panax” означает по-гречески «лечащий все», а название Panax ginseng традиционно относится к Азиатскому женьшеню. Сообщалось, что женьшень обладает различными физиологическими действиями на многочисленные системы организма, в том числе сердечно-сосудистую, иммунную и нейронную. Он также применяется для улучшения сексуальных показателей и удовлетворения. В этом обзоре мы обобщаем действия женьшеня на мужские сексуальные характеристики и сперматогенез. Обсуждаются недавние свидетельства о его механизмах действия, которые могут представлять новые терапевтические стратегии в лечении заболеваний и расстройств мужской репродуктивной системы.
Сексуальные характеристики
Эрекция
Женьшень обычно применяется сам по себе или с растительной формулой для улучшения сексуальных характеристик в традиционной китайской медицине. Его благоприятные эффекты были научно оценены и подтверждены в мета-анализах рандомизованных клинических испытаний (6). Например, в двойном слепом плацебо-контрольном исследовании у 45 мужчин с сексуальной дисфункцией от умеренной до тяжелой было отмечено улучшение показателей эрекции и сексуального удовлетворения после курса лечения Корейским красным женьшенем – 3 раза в день при суточной дозе 900 мг в течение 8 недель (7). В аналогичном исследовании 60 мужчин с эректильной дисфункцией наблюдалось улучшение эректильной функции, включая твердость, проникновение и поддержание эрекции после приема Корейского красного женьшеня (1000 мг) 3 раза в день в течение 12 недель.
В исследованиях на животных лечение Корейским красным женьшенем и экстрактом ягод женьшеня показало значительное расслабление предварительно сокращенной гладкой мускулатуры тела полового члена кроликов in vitro и повышение внутрикавернозного давления у крыс in vivo (9, 10). Данные из исследований экстракта ягод женьшеня указывают на то, что это действие зависит от оксида азота (NO). Известно, что эти фармакологически активные компоненты женьшеня, гинзенозиды, могут индуцировать синтез NO в клетках эндотелия и периваскулярных нервах и увеличивать чувствительность клеток сосудов гладкой мускулатуры к NO (11, 12). Это высвобождение NO вызывает расслабление гладкой мускулатуры, тем самым обеспечивая большее поступление крови к эректильным телам, известным как кавернозное тело, и вызывая эрекцию (13). Среди гинзенозидов был обнаружен Rg1 для выработки NO в клетках эндотелия с помощью не-геномного, зависимого от глюкокортикоидного рецептора (ГР) механизма (14), и прием Rg1 (10 мг/кг) значительно улучшает выработку NO и накопление циклической GMP (cGMP) в кавернозном теле мыши (15).
Либидо
Исследования на грызунах показали, что и Азиатский женьшень (Panax ginseng), и Американский женьшень (Panax quinquefolium) (17) могут облегчать копулятивное поведение. Ежедневное лечение Азиатским женьшенем (25-100 мг/кг) или гинзенозидом Rg1 (2,5-10 мг/кг) показывает зависящее от дозировки увеличение случаев поднятия, вхождения и лизания пениса у мышей при виде эстральных самок (18). Такое действие не наблюдалось у мышей, получавших гинзенозиды Rb1, Rb2 и Ro.
Половое влечение у высших млекопитающих включает в себя сложную координацию между гормональными и нейрональными компонентами. Мужской половой стероид, тестостерон, синтезируется клетками Лейдига под контролем лютеинизирующего гормона (ЛГ), который вырабатывается передней частью гипофиза (19). Уровень тестостерона строго взаимосвязан с либидо, поэтому тестостерон является одной из основных лекарств, прописываемых мужчинам со сниженным половым влечением (20). Интересно, что у крыс, получавших 5% Panax ginseng с кормом в течение 6 дней, наблюдалось значительное повышение уровня тестостерона в крови, тогда как лечением 1% Panax ginseng не имело эффекта (21). Гинзенозид Rg1 (10 мг/кг), главный активный компонент Panax ginseng, отвечает за повышение уровня тестостерона в сыворотке крови и наблюдаемое улучшение копулятивного поведения (15). Обнаружено, что гинзенозид Rb1 (10 µg/kg), главный гинзенозид, обнаруженный в Американском женьшене, увеличивает выработку ЛГ, воздействуя непосредственно на переднюю часть гипофиза (22). Клиническое исследование 66 участников с использованием экстракта Азиатского женьшеня показало значительное увеличение в плазме крови уровня общего и свободного тестостерона, фолликулостимулирующего гормона и ЛГ (23). Однако оральное введение Американского женьшеня (10-100 мг/кг) в течение 28 дней, по-видимому, не изменило уровень тестостерона и ЛГ у крыс (18), указывая на то, что этот вид женьшеня и длительность лечения могут иметь иное действие на способность повышать либидо.
Некоторые нейротрансмиттеры, вовлеченные в либидо, такие как допамин (ДА) для желания, ацетилхолин (АХ) для пробуждения, и ГАМК для оргазма. Оказалось, что гинзенозид Re увеличивает внутриклеточный уровень ДА и АХ в мозгу крыс (24). Действие гинзенозида Rb1 на выработку АХ связано с увеличением поглощения холина нервными окончаниями (25). Выяснилось, что экстракт Американского женьшеня модулирует ГАМК эргическиую нейротрансмиссию в нейронах ствола головного мозга крыс (26). Анализы связывания рецептор-лиганд показали, что гинзенозиды Rb1, Rb2, Rc, Re, Rf и Rg1 являются агноистами ГАМК(А) рецептора, а Rc выступает агонистом также для ГАМК(В) рецептора (27). Эти выводы указывают на то, что женьшень может регулировать гипофизарно-тестикулярную ось как на гормональном, так и на нейрональном уровне.
Выработка и качество спермы
Исследования последних более чем 20 лет показали, что количество сперматозоидов снижается во многих странах мира. Например, исследование 26000 французских мужчин показало постоянное снижение концентрации спермы за 17-летний период (28). Обнаружено снижение на 32% по сравнению со средним уровнем спермы у 35-летних мужчин между 1985 и 2005 гг. (28). Причины не до конца понятны, но снижение плодовитости по всему миру может указывать на общее ухудшение мужского самочувствия, которое становится однjq из главных проблем здравоохранения. Таким образом, есть потребность в дальнейшем выяснении причин и поиске мер для предотвращения этого.
Число и подвижность сперматозоидов
Первоначальное свидетельство, что женьшень может оказывать положительное действие на сперматогенез было впервые опубликовано в 1977 году. При этом было продемонстрирован стимулирующий эффект экстрактов женьшеня на синтез ДНК и белков в семенниках крыс (29). Более поздние исследования на грызунах и на людях показали, что женьшень может увеличивать число сперматозоидов. У крыс, получавших женьшень, наблюдалось усиление скорости сперматогенеза через рост экспрессии нейротрофического фактора глиальных клеток (GDNF) в клетках Сертоли (30) и активацию тестикулярного цАТФ-чувствительного элемента модулятора (CREM) (31). GDNF является возможным регулятором выживания и решения судьбы недифференцированных сперматогониальных клеток (32, 33), а CREM важен для созревания сперматид (34). У мужчины с низким белком CREM/мРНК или его отсутствием наблюдается специфический арест круглых сперматид, что может быть возможной причиной бесплодия (35). Как у пациентов с олигоастеноспермией, так и у здоровых мужчин соответствующего возраста наблюдалось увеличение плотности и подвижности сперматозоидов после применения Panax ginseng (23). У пациентов с астеноспермией, лечившихся женьшенем, также наблюдалось значительное увеличение прогрессивной подвижности спермы (36). Оказалось, что водные, органические и полисахаридные фракции Panax notoginseng улучшают направленную подвижность человеческих сперматозоидов за 6-120 мин. (37). Подобным же образом, гинзенозиды Rc и Rb2 (0,01 мг/м) демонстрировали способность улучшать прогрессию спермы in vitro (38). Чтобы определить конкретные активные компоненты этого действия, было обнаружено, что эти эффекты опосредованы индукцией свойств синтазы оксида азота (NOS) и выработкой NO (39). NO также тесно связан с функцией спермы. Гинсенозид Re (1–100 μM) продемонстрировал способность облегчать капацитацию человеческой спермы и акросомную реакцию через улучшение внутриклеточной выработки NO (40).
Сохранение спермы
Также обнаружено, что женьшень помогает сохранять эякулированную сперму. Было показано, что количество сперматозоидов эякулированной спермы, инкубированное с экстрактом женьшеня, значительно выше, чем количество, обработанное растворителем (41). Лечение гинсенозидом Rg1 (50 μg/ml) существенно повышает подвижность спермы и проницаемость мембраны спермы после оттаивания по сравнению со свежей не подвергавшейся таянию спермы (42). Эти выводы указывают на то, что добавление экстракта женьшеня к криогену для хранения спермы позволит улучшить плодовитость.
Действие женьшеня на сперматогенез во время состояний болезни
Известно, что традиционные методы лечения рака часто ведут к нарушениям воспроизводства разной степени, и эти эффекты могут быть как временными, так и постоянными. Циклофосфамид (ЦФ) является алкилирующим агентом, который демонстрирует цитостатический эффект, образуя ковалентную ДНК-аддукты. Так как целями ЦФ являются стремительно делящиеся клетки, он широко используется для подавления злокачественных опухолей и как средство для подавления иммунитета при трансплантации органов пациенту. Однако это лекарство часто ведет к интоксикации половых желез и бесплодию и, как следствие, разочаровывает многих пациентов, выбравших лечение ЦФ. Было показано, что прием Американского женьшеня (500 мг/кг/день) может защитить сперму, в частности, за счет увеличения количества спермы, снижения смертности и аномалий сперматозоидов и восстановления подвижности спермы из–за воздействия ЦФ у взрослых самцов крыс породы Вистар по сравнению с лечением одним только ЦФ (43). Кроме того, показано, что лечение протопаназатриола сапонином заметно уменьшает вызванные гемотерапевтическим агентом (бусульфан) структурные недостатки семенников у мышей, указывая на то, что женьшень может найти применение в восстановлении мужского бесплодия после лечения рака (44).
Лучевая терапия иногда прописывается пациентам как часть лечения рака. Однако неселективное действие лучевой терапии может также повреждать нормальные клетки, приводя к побочным эффектам. Амифостин(WR-2721) является одним из радиопротекторов, зарегистрированных для использования в лечении людей, но его применение ведет ко множеству негативных побочных эффектов, таких как гипертония, тошнота и рвота (45). Это соединение также цитотоксично для стволовой сперматогонии, что ограничивает его клиническое применение. Интересно отметить, что внутрибрюшинная инъекция экстракта Panax ginseng (10 мг/кг) взрослым самцам швейцарских мышей-альбиносов в течение 4 дней может защитить популяцию половых клеток от и действовать против γ-излучения, а также радикально уменьшает заболевания, связанные с γ-излучением, включая анорексию, диарею, потерю веса, летаргию и выпадение волос (47).
Зеараленон (ZEA) является эстрогенным микотоксином, который обычно заражает окружающую среду, так как встречается в зерновых культурах, что вызывает нарушения репродуктивной системы у сельскохозяйственного скота. Прием Корейского красного женьшеня (300 мг/кг) в течение 4 недель через день может предотвратить вызванное зеараленоном нарушение сперматогенеза у крыс путем модуляции экспрессии Fas/Fas-лиганда(48).
Мужчины с инсулиннезависимым сахарным диабетом (диабет 2 типа) часто страдают от сексуальной дисфункции (49). Исследования обнаружили благоприятное воздействие приема женьшеня. Например, оказалось, что введение стандартизированного экстракта женьшеня (100 мг/кг) в день в течение 90 дней у крыс с диабетом, вызванным стрептозотоцином, ведет к значительному улучшению показателей плодовитости и уменьшению патологических признаков семенников, таких как дегенеративные изменения в семенных канальцах (50). Кроме того, прием Корейского красного женьшеня (30 мг/кг, три раза в неделю в течение 1 месяца) может помочь улучшить либидо и сексуальные показатели у самцов крыс с диабетом 2 типа, вызванным стрептозоцином (51). Кроме того, было показано, что женьшень может стабилизировать прогрессирование заболевания диабетом. В ходе двойного слепого плацебо-контрольного исследования было показано, что на фоне ежедневного приема женьшеня (100 или 200 мг) среди пациентов с диабетом 2 типа наблюдалось снижение уровня глюкозы в крови натощак и веса тела, а также улучшение гликированного гемоглобина, концентрации N-концевого пропептида в сыворотке, психологических показателей и физических нагрузок (52). Подобным же образом было показано, что Корейский красный женьшень может улучшать уровень cGMP кавернозного тела у крыс с метаболическим синдромом и поэтому может улучшать эректильную функцию (53).
Продолжительное воздействие токсинов окружающей среды считается причиной снижения плодовитости. Было показано, что женьшень обладает цитопротективным действием против этих токсинов, при котором, как сообщалось, введение экстракта Panax ginseng значительно уменьшает патологические и генотоксические поражения в семенниках крыс, вызванные 2,3,7,8-тетрахлордибензо-р-диоксином (54). Кроме того, обнаружено, что лечение с помощью Panax ginseng защищает клетки Сертоли от цитотоксического действия бисфенола А (55).
Механизмы действия сперматид
Гинзенозиды представляют три трепеноидные сапонины, структурно схожие со стероидными гормонами. Таким образом, заманчиво предположить, что действие гинзенозидов на половую функцию и сперматогенез является результатом активации стероидных рецепторов. Андрогены являются половыми гормонами, которые незаменимы для развития и поддержания мужских сексуальных характеристик и регулируют нормальный сперматогенез. Андрогенный рецептор (АР) в изобилии вырабатываются в тканях мужских гениталий и сперматозоидах (56), и их выработка существенно снижается у бесплодных мужчин (57). Сообщалось, что гинзенозиды Rb1 и Re являются агонистами АР, посредством которых эти гинзенозиды стимулируют выработку NO через активацию NOS (58, 59). Экстракт ягод женьшеня GB0710, ключевым ингредиентом которого является гинзенозид Re, может улучшать эректильную дисфункцию у крыс путем индукции выработки NO (10). Также было показано, что индуцируемая Re выработка NO в сперме вовлечена в капацитацию и акросомную реакцию, и что эти действия могут быть результатом не-геномной активности взаимодействия Re и АР (40).
Эстроген является другим гормоном, оказывающим глубокое воздействие на половую функцию как мужчин, так и женщин. Было показано, что прием добавок эстрогена улучшает сексуальную функцию у мужчин с дефицитом тестостерона (60). В связи с этим, хотя у мышей сα-нокаутированным эстрогенным рецептором (ЭР) наблюдается непрерывное развитие репродуктивного тракта, эти мыши проявляют менее мужское половое поведение (61) и имеют намного более низкий показатель плодовитости (62). Некоторые гинзенозиды, в том числе Rb1, Re, Rg1, Rg3, тRh1, являются агонистами ЭРα, которые, как было показано, вызывают как рецептор-зависимые транскрипционные, так и нетранскрипционные эстрогенные действия у нескольких типов клеток (58, 63-66). В связи с этим сообщалось, что ЭР был обнаружен в человеческих сперматозоидах, и что он находится в основном в плазматической мембране (67-70), что указывает на то, что гинзенозиды могут модулировать мужскую сексуальную функцию путем не-геномного взаимодействия с ЭР.
Экспрессия рецептора прогестерона (ПР) наблюдалась в человеческой сперме, была также показана тесная взаимосвязь между экспрессией ПР и функцией спермы (71). Любопытно, что в отличие от эстрогенов, прогестерон способствует тому, чтобы сперма могла подвергаться акросомальной реакции (72, 73). Соответственно, несколько исследований in vitro продемонстрировали ингибирующее действие прогестерона на эстрогены и наоборот. Например, эстроген-индуцированное движение человеческих сперматозоидов вперед в маточную трубу может быть успешно подавлено прогестероном (74-77). Кроме того, было показано, что прогестерон, вырабатываемый кучевыми клетками, окружающими ооцит, чтобы вызвать гиперактивацию спермы, ингибировался в присутствии эстрогена (78). С другой стороны, эстроген и прогестерон могут взаимодействовать, чтобы оптимизировать их влияние на оплодотворение (79, 80). Экстракты женьшеня содержат смесь гинзенозидов, которые могут активировать как ЭР и/или ПР, так и, следовательно, могут модулировать разные аспекты функции спермы. Оказываемое гинзенозидом Re действие, улучшающее подвижность сперматозоидов, может быть связано с тем открытием, что Re является агонистом ЭР и ПР (58).
Заключительные замечания и будущие перспективы
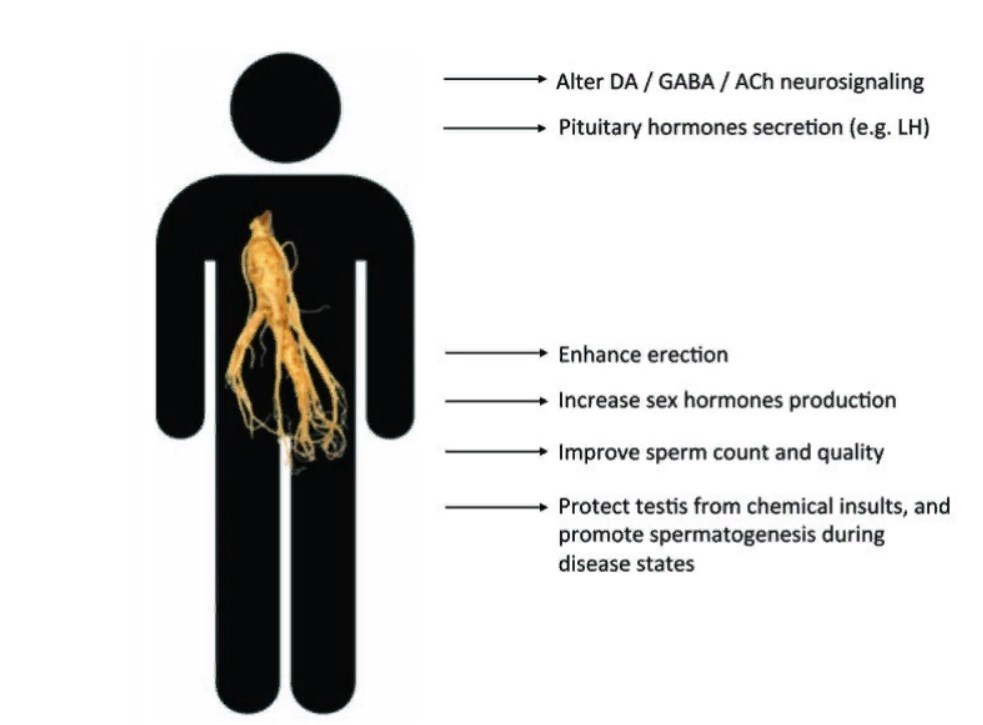
Женьшень является жизненно необходимым компонентом традиционной китайской медицины и на протяжении тысячелетий использовался для лечения различных физических состояний, как афродизиак и для лечения сексуальных дисфункций, а также для улучшения сексуального поведения и функции половых желез (Рис.1). Поэтому применение женьшеня представляется важным для разработки новых методов терапии или для усиления эффективности современных стратегий лечения заболеваний или нарушений мужской репродуктивной системы. Однако его молекулярные механизмы действия по-прежнему не вполне понятны. В этой области необходимы дополнительные исследования. Разносторонний анализ профилирования с высокопропускной способностью представляется полезным для выявления молекулярных функций различных гинзенозидов и того, как организованы разные сигнальные сети. Требуются также дальнейшие оценки, чтобы утвердить некоторые лекарственные преимущества с использованием современных аналитических средств и основанных на технологии анализов. Также нужны различные подходы к синтезу и/или модификации природных гинзенозидов для повышения эффективности/действенности, метаболической стабильности и оральной биодоступности для клинического применения.
Текстовки к Рисунку 1:
- После нейронной сигнализации ДА/ГАМК/АХ
- Выработка гормонов гипофиза (например, ЛГ)
- Улучшение эрекции
- Увеличение выработки половых гормонов
- Улучшение количества сперматозоидов и качества спермы
- Защита семенных желез от химических воздействий и способствование сперматогенезу во время заболеваний
Рисунок 1. Действие женьшеня на мужскую половую функцию. Женьшень улучшает сексуальные характеристики, увеличивает мужскую плодовитость путем модулирования нейрональной и гормональной систем, способствует сперматогенезу и действует непосредственно на сперму через стероидные рецепторы. Женьшень также сохраняет мужскую плодовитость во время заболеваний.
Раскрытие потенциальных конфликтов интересов
Никаких потенциальных конфликтов интересов не было раскрыто.
Словарь
Аббревиатуры:
| ACh | acetylcholine | АХ, ацетилхолин |
| AR | androgenreceptor | АР, андрогенный рецептор |
| cGMP | cyclicguanosinemonophosphate | cGMP, циклический гуанозинмонофосфат |
| CREM | cAMP-responsiveelementmodulator | CREM, цАТФ(циклический аденозинмонофосфат)-чувствительный элемент модулятора |
| CP | cyclophosphamide | ЦФ, циклофосфамид |
| DA | dopamine | ДА, допамин |
| ER | estrogenreceptor | ЭР, эстрогенный рецептор |
| GABA | gamma-aminobutyricacid | ГАМК, гамма-аминомасляная кислота |
| GDNF | glial cell-derived neurotrophic factor | GDNF, нейротрофический фактор глиальных клеток |
| GR | glucocorticoid receptor | ГР, глюкокортикоидный рецептор |
| LH | luteinizing hormone | ЛГ, лютеинизирующий гормон |
| NO | nitric oxide | NO, оксид азота |
| NOS | nitricoxidesynthase | NOS, синтаза оксида азота |
| PR | progesteronereceptor | ПР, прогестерона рецептор |
| ZEA | zearalenone | Зеараленон |
Примечания
10.4161/spmg.26391
Спонсоры
Эта работа была осуществлена при поддержке Фонда Здравоохранения и Медицинских исследования (This work wassupported by the Health and Medical Research Fund) 11121191, Благотворительным Фондом Гонконгского Жокейского Клуба (Hong Kong Jockey Club Charities Trust (HKJCCT)), HKU Strategic Research Themeon Drug, и Croucher Senior Research Fellowshipto Alice ST Wong.
Подстраничные примечания
Ранее опубликовано онлайн: www.landesbioscience.com/journals/spermatogenesis/article/26391
Ссылки
- Mascarenhas MN, Flaxman SR, Boerma T, Vanderpoel S, Stevens GA. National, regional, and global trends in infertility prevalence since 1990: a systematic analysis of 277 health surveys. PLoS Med. 2012;9:e1001356. doi: 10.1371/journal.pmed.1001356. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- American Society for Reproductive Medicine. Quick Facts about Infertility. 2013
- Smith JF, Eisenberg ML, Millstein SG, Nachtigall RD, Shindel AW, Wing H, Cedars M, Pasch L, Katz PP, Infertility Outcomes Program Project Group The use of complementary and alternative fertility treatment in couples seeking fertility care: data from a prospective cohort in the United States. FertilSteril. 2010;93:2169–74. doi: 10.1016/j.fertnstert.2010.02.054. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Bardaweel SK, Shehadeh M, Suaifan GA, Kilani MV. Complementary and alternative medicine utilization by a sample of infertile couples in Jordan for infertility treatment: clinics-based survey. BMC Complement Altern Med. 2013;13:35. doi: 10.1186/1472-6882-13-35. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Stankiewicz M, Smith C, Alvino H, Norman R. The use of complementary medicine and therapies by patients attending a reproductive medicine unit in South Australia: a prospective survey. Aust N Z J ObstetGynaecol. 2007;47:145–9. doi: 10.1111/j.1479-828X.2007.00702.x. [PubMed] [CrossRef] [Google Scholar]
- Jang DJ, Lee MS, Shin BC, Lee YC, Ernst E. Red ginseng for treating erectile dysfunction: a systematic review. Br J ClinPharmacol. 2008;66:444–50. doi: 10.1111/j.1365-2125.2008.03236.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Hong B, Ji YH, Hong JH, Nam KY, Ahn TY. A double-blind crossover study evaluating the efficacy of korean red ginseng in patients with erectile dysfunction: a preliminary report. J Urol. 2002;168:2070–3. doi: 10.1016/S0022-5347(05)64298-X. [PubMed] [CrossRef] [Google Scholar]
- de Andrade E, de Mesquita AA, Claro JdeA, de Andrade PM, Ortiz V, Paranhos M, Srougi M. Study of the efficacy of Korean Red Ginseng in the treatment of erectile dysfunction. Asian J Androl. 2007;9:241–4. doi: 10.1111/j.1745-7262.2007.00210.x. [PubMed] [CrossRef] [Google Scholar]
- Choi YD, Rha KH, Choi HK. In vitro and in vivo experimental effect of Korean red ginseng on erection. J Urol. 1999;162:1508–11. doi: 10.1016/S0022-5347(05)68349-8. [PubMed] [CrossRef] [Google Scholar]
- Cho KS, Park CW, Kim CK, Jeon HY, Kim WG, Lee SJ, Kim YM, Lee JY, Choi YD. Effects of Korean ginseng berry extract (GB0710) on penile erection: evidence from in vitro and in vivo studies. Asian J Androl. 2013;15:503–7. doi: 10.1038/aja.2013.49. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Chen X, Lee TJ. Ginsenosides-induced nitric oxide-mediated relaxation of the rabbit corpus cavernosum. Br J Pharmacol. 1995;115:15–8. doi: 10.1111/j.1476-5381.1995.tb16313.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Murphy LL, Lee TJ. Ginseng, sex behavior, and nitric oxide. Ann N Y Acad Sci. 2002;962:372–7. doi: 10.1111/j.1749-6632.2002.tb04081.x. [PubMed] [CrossRef] [Google Scholar]
- Toda N, Ayajiki K, Okamura T. Nitric oxide and penile erectile function. PharmacolTher. 2005;106:233–66. doi: 10.1016/j.pharmthera.2004.11.011. [PubMed] [CrossRef] [Google Scholar]
- Leung KW, Cheng YK, Mak NK, Chan KKC, Fan TPD, Wong RN. Signaling pathway of ginsenoside-Rg1 leading to nitric oxide production in endothelial cells. FEBS Lett. 2006;580:3211–6. doi: 10.1016/j.febslet.2006.04.080. [PubMed] [CrossRef] [Google Scholar]
- Wang X, Chu S, Qian T, Chen J, Zhang J. Ginsenoside Rg1 improves male copulatory behavior via nitric oxide/cyclic guanosine monophosphate pathway. J Sex Med. 2010;7:743–50. doi: 10.1111/j.1743-6109.2009.01482.x. [PubMed] [CrossRef] [Google Scholar]
- Kim C, Choi H, Kim CC, Kim JK, Kim MS. Influence of ginseng on mating behavior of male rats. Am J Chin Med (Gard City N Y) 1976;4:163–8. doi: 10.1142/S0192415X76000202. [PubMed] [CrossRef] [Google Scholar]
- Murphy LL, Cadena RS, Chávez D, Ferraro JS. Effect of American ginseng (Panaxquinquefolium) on male copulatory behavior in the rat. PhysiolBehav. 1998;64:445–50. doi: 10.1016/S0031-9384(98)00054-7. [PubMed] [CrossRef] [Google Scholar]
- Yoshimura H, Kimura N, Sugiura K. Preventive effects of various ginseng saponins on the development of copulatory disorder induced by prolonged individual housing in male mice. Methods Find ExpClinPharmacol. 1998;20:59–64. doi: 10.1358/mf.1998.20.1.485633. [PubMed] [CrossRef] [Google Scholar]
- Nelson WO. The male sex hormone: Some factors controlling its production and some of its effects on the reproductive organs. Ohio J Sci. 1937;37:378–93. [Google Scholar]
- Seftel AD, Mack RJ, Secrest AR, Smith TM. Restorative increases in serum testosterone levels are significantly correlated to improvements in sexual functioning. J Androl. 2004;25:963–72. [PubMed] [Google Scholar]
- Fahim MS, Fahim Z, Harman JM, Clevenger TE, Mullins W, Hafez ES. Effect of Panax ginseng on testosterone level and prostate in male rats. Arch Androl. 1982;8:261–3. doi: 10.3109/01485018208990207. [PubMed] [CrossRef] [Google Scholar]
- Tsai SC, Chiao YC, Lu CC, Wang PS. Stimulation of the secretion of luteinizing hormone by ginsenoside-Rb1 in male rats. Chin J Physiol. 2003;46:1–7. [PubMed] [Google Scholar]
- Salvati G, Genovesi G, Marcellini L, Paolini P, De Nuccio I, Pepe M, Re M. Effects of Panax Ginseng C.A. Meyer saponins on male fertility. Panminerva Med. 1996;38:249–54. [PubMed] [Google Scholar]
- Shi J, Xue W, Zhao WJ, Li KX. Pharmacokinetics and dopamine/acetylcholine releasing effects of ginsenoside Re in hippocampus and mPFC of freely moving rats. ActaPharmacol Sin. 2013;34:214–20. doi: 10.1038/aps.2012.147. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Benishin CG. Actions of ginsenoside Rb1 on choline uptake in central cholinergic nerve endings. Neurochem Int. 1992;21:1–5. doi: 10.1016/0197-0186(92)90061-U. [PubMed] [CrossRef] [Google Scholar]
- Yuan CS, Attele AS, Wu JA, Liu D. Modulation of American ginseng on brainstem GABAergic effects in rats. J Ethnopharmacol. 1998;62:215–22. doi: 10.1016/S0378-8741(98)00066-X. [PubMed] [CrossRef] [Google Scholar]
- Kimura T, Saunders PA, Kim HS, Rheu HM, Oh KW, Ho IK. Interactions of ginsenosides with ligand-bindings of GABA(A) and GABA(B) receptors. Gen Pharmacol. 1994;25:193–9. doi: 10.1016/0306-3623(94)90032-9. [PubMed] [CrossRef] [Google Scholar]
- Rolland M, Le Moal J, Wagner V, Royère D, De Mouzon J. Decline in semen concentration and morphology in a sample of 26,609 men close to general population between 1989 and 2005 in France. Hum Reprod. 2013;28:462–70. doi: 10.1093/humrep/des415. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Yamamoto M, Kumagai A, Yamamura Y. Stimulatory effect of Panax ginseng principles on DNA and protein synthesis in rat testes. Arzneimittelforschung. 1977;27:1404–5. [PubMed] [Google Scholar]
- Yang WM, Park SY, Kim HM, Park EH, Park SK, Chang MS. Effects of Panax ginseng on glial cell-derived neurotrophic factor (GDNF) expression and spermatogenesis in rats. Phytother Res. 2011;25:308–11. [PubMed] [Google Scholar]
- Park WS, Shin DY, Kim R, Yang WM, Chang MS, Park SK. Korean ginseng induces spermatogenesis in rats through the activation of cAMP-responsive element modulator (CREM) FertilSteril. 2007;88:1000–2. doi: 10.1016/j.fertnstert.2006.12.014. [PubMed] [CrossRef] [Google Scholar]
- Meng X, Lindahl M, Hyvönen ME, Parvinen M, de Rooij DG, Hess MW, Raatikainen-Ahokas A, Sainio K, Rauvala H, Lakso M, et al. Regulation of cell fate decision of undifferentiated spermatogonia by GDNF. Science. 2000;287:1489–93. doi: 10.1126/science.287.5457.1489. [PubMed] [CrossRef] [Google Scholar]
- de Rooij DG. Proliferation and differentiation of spermatogonial stem cells. Reproduction. 2001;121:347–54. doi: 10.1530/rep.0.1210347. [PubMed] [CrossRef] [Google Scholar]
- Behr R, Weinbauer GF. cAMP response element modulator (CREM): an essential factor for spermatogenesis in primates? Int J Androl. 2001;24:126–35. doi: 10.1046/j.1365-2605.2001.00277.x.[PubMed] [CrossRef] [Google Scholar]
- Steger K, Behr R, Kleiner I, Weinbauer GF, Bergmann M. Expression of activator of CREM in the testis (ACT) during normal and impaired spermatogenesis: correlation with CREM expression. Mol Hum Reprod. 2004;10:129–35. doi: 10.1093/molehr/gah012. [PubMed] [CrossRef] [Google Scholar]
- Morgante G, Scolaro V, Tosti C, Di Sabatino A, Piomboni P, De Leo V. [Treatment with carnitine, acetyl carnitine, L-arginine and ginseng improves sperm motility and sexual health in men with asthenopermia] Minerva UrolNefrol. 2010;62:213–8. [PubMed] [Google Scholar]
- Chen JC, Xu MX, Chen LD, Chen YN, Chiu TH. Effect of panaxnotoginseng extracts on inferior sperm motility in vitro. Am J Chin Med. 1999;27:123–8. doi: 10.1142/S0192415X9900015X. [PubMed] [CrossRef] [Google Scholar]
- Chen JC, Chen LD, Tsauer W, Tsai CC, Chen BC, Chen YJ. Effects of Ginsenoside Rb2 and Rc on inferior human sperm motility in vitro. Am J Chin Med. 2001;29:155–60. doi: 10.1142/S0192415X01000174. [PubMed] [CrossRef] [Google Scholar]
- Zhang H, Zhou QM, Li XD, Xie Y, Duan X, Min FL, Liu B, Yuan ZG. GinsenosideR(e) increases fertile and asthenozoospermic infertile human sperm motility by induction of nitric oxide synthase. Arch Pharm Res. 2006;29:145–51. doi: 10.1007/BF02974276. [PubMed] [CrossRef] [Google Scholar]
- Zhang H, Zhou Q, Li X, Zhao W, Wang Y, Liu H, Li N. Ginsenoside Re promotes human sperm capacitation through nitric oxide-dependent pathway. MolReprod Dev. 2007;74:497–501. doi: 10.1002/mrd.20583. [PubMed] [CrossRef] [Google Scholar]
- Wiwanitkit V. In Vitro Effect of Ginseng Extract on Sperm Count. Sex Disabil. 2005;23:241–3. doi: 10.1007/s11195-005-8931-2. [CrossRef] [Google Scholar]
- Kim DY, Hwang YJ. Effects of ginsenoside-Rg1 on post-thawed miniature pig sperm motility, mitochondria activity and membrane integrity. J Emb Trans. 2013 doi: 10.12750/JET.2013.28.1.63.[CrossRef] [Google Scholar]
- Akram H, GhaderiPakdel F, Ahmadi A, Zare S. Beneficial effects of american ginseng on epididymal sperm analyses in cyclophosphamide treated rats. Cell J. 2012;14:116–21. [PMC free article][PubMed] [Google Scholar]
- Ji M, Mnami N, Yamada M, Imai H. Effect of protopanaxatriolsaponin on spermatogenic stem cell survival in busulfan-treated male mice. Reprod Med Biol. 2007;6:99–108. doi: 10.1111/j.1447-0578.2007.00172.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Gosselin TK, Mautner B. Amifostine as a radioprotectant. Clin J OncolNurs. 2002;6:175–6, 180. doi: 10.1188/02.CJON.175-176. [PubMed] [CrossRef] [Google Scholar]
- Meistrich ML, Finch MV, Hunter N, Milas L. Cytotoxic effects of WR-2721 on mouse testicular cells. Int J RadiatOncolBiol Phys. 1984;10:1551–4. doi: 10.1016/0360-3016(84)90501-7. [PubMed] [CrossRef] [Google Scholar]
- Kumar M, Sharma MK, Saxena PS, Kumar A. Radioprotective effect of Panax ginseng on the phosphatases and lipid peroxidation level in testes of Swiss albino mice. Biol Pharm Bull. 2003;26:308–12. doi: 10.1248/bpb.26.308. [PubMed] [CrossRef] [Google Scholar]
- Cho ES, Ryu SY, Jung JY, Park BK, Son HY. Effects of red ginseng extract on zearalenone induced spermatogenesis impairment in rat. J Ginseng Res. 2011;35:294–300. doi: 10.5142/jgr.2011.35.3.294.[PMC free article][PubMed] [CrossRef] [Google Scholar]
- Penson DF, Wessells H. Erectile dysfunction in diabetic patients. Diabetes Spectrum. 2004;17:4225–30. doi: 10.2337/diaspect.17.4.225. [CrossRef] [Google Scholar]
- Sawiress FA, Ziada MS, Bebawy WS, Amer HA. Effect of ginseng extract supplementation on testicular functions in diabetic rats. EndocrRegul. 2011;45:139–48. doi: 10.4149/endo_2011_03_139.[PubMed] [CrossRef] [Google Scholar]
- Ryu JK, Lee T, Kim DJ, Park IS, Yoon SM, Lee HS, Song SU, Suh JK. Free radical-scavenging activity of Korean red ginseng for erectile dysfunction in non-insulin-dependent diabetes mellitus rats. Urology. 2005;65:611–5. doi: 10.1016/j.urology.2004.10.038. [PubMed] [CrossRef] [Google Scholar]
- Sotaniemi EA, Haapakoski E, Rautio A. Ginseng therapy in non-insulin-dependent diabetic patients. Diabetes Care. 1995;18:1373–5. doi: 10.2337/diacare.18.10.1373. [PubMed] [CrossRef] [Google Scholar]
- Kim SD, Kim YJ, Huh JS, Kim SW, Sohn DW. Improvement of erectile function by Korean red ginseng (Panax ginseng) in a male rat model of metabolic syndrome. Asian J Androl. 2013;15:395–9. doi: 10.1038/aja.2012.159. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Lee JH, Sul D, Oh E, Jung WW, Hwang KW, Hwang TS, Lee KC, Won NH. Panax ginseng effects on DNA damage, CYP1A1 expression and histopathological changes in testes of rats exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin. Food ChemToxicol. 2007;45:2237–44. doi: 10.1016/j.fct.2007.05.019.[PubMed] [CrossRef] [Google Scholar]
- Wang L, Hao J, Hu J, Pu J, Lü Z, Zhao L, Wang Q, Yu Q, Wang Y, Li G. Protective effects of ginsenosides against Bisphenol A-induced cytotoxicity in 15P-1 Sertoli cells via extracellular signal-regulated kinase 1/2 signalling and antioxidant mechanisms. Basic ClinPharmacolToxicol. 2012;111:42–9. [PubMed] [Google Scholar]
- Solakidi S, Psarra AMG, Nikolaropoulos S, Sekeris CE. Estrogen receptors α and β (ERalpha and ERbeta) and androgen receptor (AR) in human sperm: localization of ERbeta and AR in mitochondria of the midpiece. Hum Reprod. 2005;20:3481–7. doi: 10.1093/humrep/dei267. [PubMed] [CrossRef] [Google Scholar]
- Zalata AA, Mokhtar N, BadawyAel-N, Othman G, Alghobary M, Mostafa T. Androgen receptor expression relationship with semen variables in infertile men with varicocele. J Urol. 2013;189:2243–7. doi: 10.1016/j.juro.2012.11.112. [PubMed] [CrossRef] [Google Scholar]
- Furukawa T, Bai CX, Kaihara A, Ozaki E, Kawano T, Nakaya Y, Awais M, Sato M, Umezawa Y, Kurokawa J. Ginsenoside Re, a main phytosterol of Panax ginseng, activates cardiac potassium channels via a nongenomic pathway of sex hormones. MolPharmacol. 2006;70:1916–24. doi: 10.1124/mol.106.028134. [PubMed] [CrossRef] [Google Scholar]
- Yu J, Eto M, Akishita M, Kaneko A, Ouchi Y, Okabe T. Signaling pathway of nitric oxide production induced by ginsenoside Rb1 in human aortic endothelial cells: a possible involvement of androgen receptor. BiochemBiophys Res Commun. 2007;353:764–9. doi: 10.1016/j.bbrc.2006.12.119. [PubMed] [CrossRef] [Google Scholar]
- Kacker R, Traish AM, Morgentaler A. Estrogens in men: clinical implications for sexual function and the treatment of testosterone deficiency. J Sex Med. 2012;9:1681–96. doi: 10.1111/j.1743-6109.2012.02726.x. [PubMed] [CrossRef] [Google Scholar]
- Wersinger SR, Sannen K, Villalba C, Lubahn DB, Rissman EF, De Vries GJ. Masculine sexual behavior is disrupted in male and female mice lacking a functional estrogen receptor alpha gene. HormBehav. 1997;32:176–83. doi: 10.1006/hbeh.1997.1419. [PubMed] [CrossRef] [Google Scholar]
- Lubahn DB, Moyer JS, Golding TS, Couse JF, Korach KS, Smithies O. Alteration of reproductive function but not prenatal sexual development after insertional disruption of the mouse estrogen receptor gene. Proc Natl AcadSci U S A. 1993;90:11162–6. doi: 10.1073/pnas.90.23.11162. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Cho J, Park W, Lee S, Ahn W, Lee Y. Ginsenoside-Rb1 from Panax ginseng C.A. Meyer activates estrogen receptor-alpha and -beta, independent of ligand binding. J ClinEndocrinolMetab. 2004;89:3510–5. doi: 10.1210/jc.2003-031823. [PubMed] [CrossRef] [Google Scholar]
- Chan RY, Chen WF, Dong A, Guo D, Wong MS. Estrogen-like activity of ginsenoside Rg1 derived from Panaxnotoginseng. J ClinEndocrinolMetab. 2002;87:3691–5. doi: 10.1210/jc.87.8.3691. [PubMed] [CrossRef] [Google Scholar]
- Shinkai K, Akedo H, Mukai M, Imamura F, Isoai A, Kobayashi M, Kitagawa I. Inhibition of in vitro tumor cell invasion by ginsenoside Rg3. Jpn J Cancer Res. 1996;87:357–62. doi: 10.1111/j.1349-7006.1996.tb00230.x. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Lee Y, Jin Y, Lim W, Ji S, Choi S, Jang S, Lee S. A ginsenoside-Rh1, a component of ginseng saponin, activates estrogen receptor in human breast carcinoma MCF-7 cells. J Steroid BiochemMol Biol. 2003;84:463–8. doi: 10.1016/S0960-0760(03)00067-0. [PubMed] [CrossRef] [Google Scholar]
- Hyne RV, Boettcher B. The selective binding of steroids by human spermatozoa. Contraception. 1977;15:163–74. doi: 10.1016/0010-7824(77)90014-2. [PubMed] [CrossRef] [Google Scholar]
- Hernández-Pérez O, Ballesteros LM, Rosado A. Binding of 17-β-estradiol to the outer surface and nucleus of human spermatozoa. Arch Androl. 1979;3:23–9. doi: 10.3109/01485017908985044. [PubMed] [CrossRef] [Google Scholar]
- Cheng CY, Boettcher B, Rose RJ, Kay DJ, Tinneberg HR. The binding of sex steroids to human spermatozoa.An autoradiographic study. Int J Androl. 1981;4:1–17. doi: 10.1111/j.1365-2605.1981.tb00685.x. [PubMed] [CrossRef] [Google Scholar]
- Cheng CY, Boettcher B, Rose RJ. Lack of cytosol and nuclear estrogen receptors in human spermatozoa. BiochemBiophys Res Commun. 1981;100:840–6. doi: 10.1016/S0006-291X(81)80250-1.[PubMed] [CrossRef] [Google Scholar]
- Gadkar S, Shah CA, Sachdeva G, Samant U, Puri CP. Progesterone receptor as an indicator of sperm function. BiolReprod. 2002;67:1327–36. doi: 10.1095/biolreprod67.4.1327. [PubMed] [CrossRef] [Google Scholar]
- Baldi E, Luconi M, Muratori M, Forti G. A novel functional estrogen receptor on human sperm membrane interferes with progesterone effects. Mol Cell Endocrinol. 2000;161:31–5. doi: 10.1016/S0303-7207(99)00220-8. [PubMed] [CrossRef] [Google Scholar]
- Vigil P, Toro A, Godoy A. Physiological action of oestradiol on the acrosome reaction in human spermatozoa. Andrologia. 2008;40:146–51. doi: 10.1111/j.1439-0272.2007.00814.x. [PubMed] [CrossRef] [Google Scholar]
- Beck KJ, Herschel S, Hungershöfer R, Schwinger E. The effect of steroid hormones on motility and selective migration of X- and Y-bearing human spermatozoa. FertilSteril. 1976;27:407–12. [PubMed] [Google Scholar]
- Hyne RV, Boettcher B. Binding of steroids to human spermatozoa and its possible role in contraception. FertilSteril. 1978;30:322–8. [PubMed] [Google Scholar]
- Trifunac NP, Bernstein GS. Effect of steroid hormones on the metabolism of human spermatozoa. Contraception. 1981;23:527–41. doi: 10.1016/0010-7824(81)90080-9. [PubMed] [CrossRef] [Google Scholar]
- Orihuela PA, Ortiz ME, Croxatto HB. Sperm migration into and through the oviduct following artificial insemination at different stages of the estrous cycle in the rat. BiolReprod. 1999;60:908–13. doi: 10.1095/biolreprod60.4.908. [PubMed] [CrossRef] [Google Scholar]
- Fujinoki M. Suppression of progesterone-enhanced hyperactivation in hamster spermatozoa by estrogen. Reproduction. 2010;140:453–64. doi: 10.1530/REP-10-0168. [PubMed] [CrossRef] [Google Scholar]
- Barboni B, Mattioli M, Seren E. Influence of progesterone on boar sperm capacitation. J Endocrinol. 1995;144:13–8. doi: 10.1677/joe.0.1440013. [PubMed] [CrossRef] [Google Scholar]
- Sebkova N, Cerna M, Ded L, Peknicova J, Dvorakova-Hortova K. The slower the better: how sperm capacitation and acrosome reaction is modified in the presence of estrogens. Reproduction. 2012;143:297–307. doi: 10.1530/REP-11-0326. [PubMed] [CrossRef] [GoogleScholar]
Articles from Spermatogenesis are provided here courtesy of Taylor & Francis